“… องค์การเภสัชกรรมเริ่มทดสอบในมนุษย์ระยะที่ 1 ไปแล้ว ตั้งแต่ 23 มี.ค.2564 ส่วนจุฬาลงกรณ์มหาวิทยาลัยเริ่มทดสอบไปแล้วเมื่อวันที่ 14 มิ.ย.2564 ล่าสุดวัคซีนทั้ง 2 ชนิดได้จัดแถลงข่าวความคืบหน้า เปิดผลการทดสอบวัคซีนต่างกระตุ้นภูมิคุ้มกันได้ดี คาดได้ใช้เป็นบูสเตอร์โดสในปี 2565 ขณะที่วัคซีนใบยากำลังเตรียมเข้าสู่การทดสอบวัคซีนในมนุษย์ระยะแรก ต้นเดือน ก.ย.นี้…”
………………………………………….
ปัจจุบันมีวัคซีนฝีมือคนไทยอยู่ด้วย 4 ชนิด ได้แก่ วัคซีน ChulaCov-19 พัฒนาโดยจุฬาลงกรณ์มหาวิทยาลัย, วัคซีน HXP-GPOVac พัฒนาโดยคณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล และองค์การเภสัชกรรม (อภ.), วัคซีน COVIGEN พัฒนาโดยบริษัทไบโอเนท-เอเชีย จำกัด และวัคซีนใบยา จากบริษัท ใบยา ไฟโตฟาร์ม จำกัด
โดยองค์การเภสัชกรรมเริ่มทดสอบในมนุษย์ระยะที่ 1 ไปแล้ว ตั้งแต่ 23 มี.ค.2564 ส่วนจุฬาลงกรณ์มหาวิทยาลัยเริ่มทดสอบไปแล้วเมื่อวันที่ 14 มิ.ย.2564 ล่าสุดวัคซีนทั้ง 2 ชนิดได้จัดแถลงข่าวความคืบหน้า เปิดผลการทดสอบวัคซีน เมื่อวันที่ 16 ส.ค.2564 สำนักข่าวอิศรา (www.isranews.org) ได้รวบรวมความคืบหน้า 3 วัคซีนฝีมือคนไทย มีรายละเอียดที่น่าสนใจ ดังนี้
วัคซีน ‘ChulaCOV-19’ ศ.นพ.สุทธิพงศ์ วัชรสินธุ ผู้อำนวยการโรงพยาบาลจุฬาภรณ์ สภากาชาดไทยและคณบดีคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และศ.นพ.เกียรติ รักษ์รุ่งธรรม ผู้อำนวยการบริหารโครงการพัฒนาวัคซีนโควิด ศูนย์วิจัยวัคซีน คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย และโรงพยาบาลจุฬาลงกรณ์ สภากาชาดไทย ได้ร่วมกันแถลงข่าวผลการทดสอบวัคซีนในอาสาสมัครระยะแรก
โดย ศ.นพ.สุทธิพงศ์ กล่าวว่า โรงพยาบาลจุฬาภรณ์ สภากาชาดไทย และคณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัยได้ดำเนินการในหลายๆ เรื่อง ไม่ว่าจะเป็นการดูแลรักษาผู้ป่วยหรือการพัฒนาเทคโนโลยีต่างๆ รวมทั้งสิ่งหนึ่งที่สำคัญและเป็นความหวังกับพวกเราชาวไทย คือ วัคซีน
วัคซีนนี้ พัฒนามาจากศูนย์วิจัยวัคซีน คณะแพทยศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ซึ่งเป็นศูนย์วัคซีนที่ได้รับความร่วมมือจากนักวิจัยทั้งในระดับชาติและระดับโลกมาร่วมมือวิจัย ต่อยอด และคิดค้น
ภายใต้การดูแลจากหลายภาคส่วนทั้งในภาครัฐ เอกชน และภาคประชาชนที่ได้มีส่วนร่วมในการขับเคลื่อนงานวิจัยชิ้นนี้ ตนเองหวังว่าผลการดำเนินงานขั้นถัดไปน่าจะเป็นประโยชน์และเป็นความหวัง ซึ่งจะทำให้วัคซีที่ผลิตโดยคนไทย แล้วก็ใช้กับประชาชนชาวไทยนี้ ประสบความสำเร็จได้ในระยะเวลาอีกไม่นาน
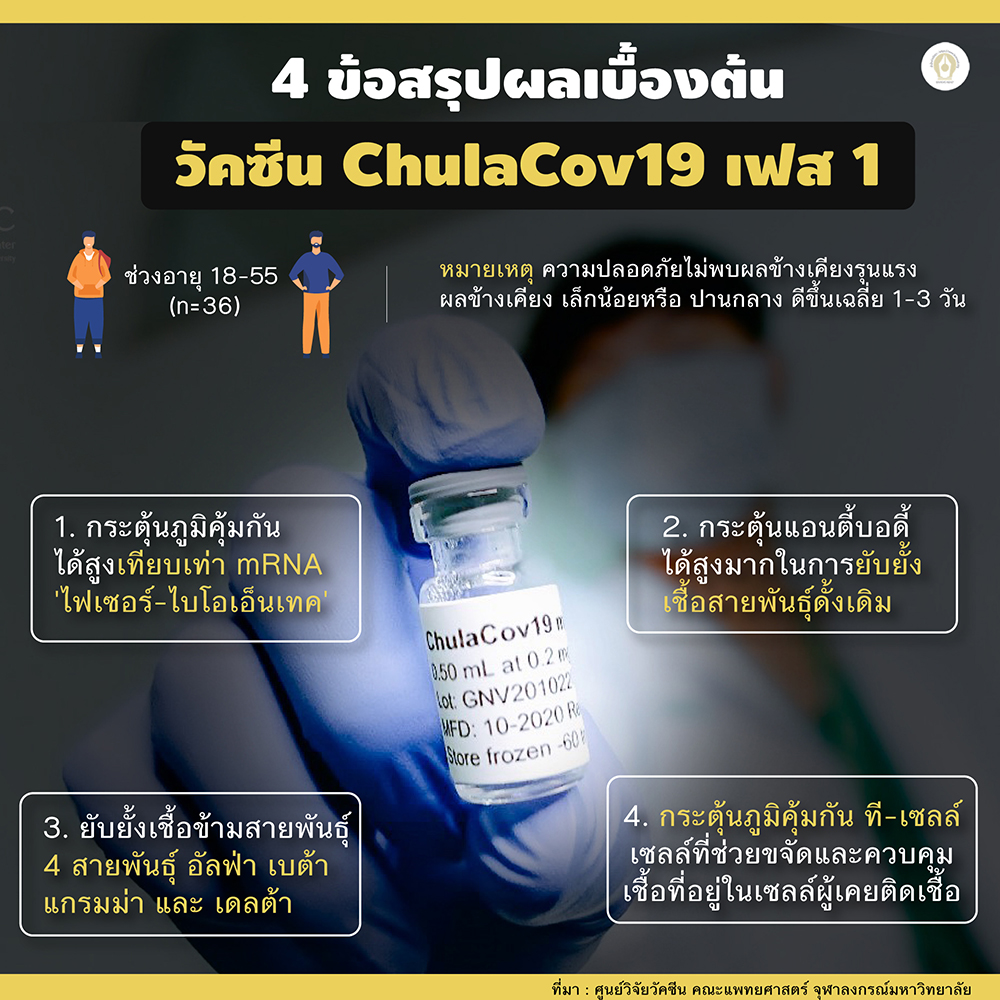
“เมื่อต้นปีที่ผ่านมาChulaCOV-19ได้ผ่านการทดลองในสัตว์ทดลองทั้งหนูและลิง พบว่ามีประสิทธิภาพสร้างภูมิคุ้มกันได้ในระดับสูง ต่อมาเมื่อวันที่ 14 มิ.ย.2564 เราได้มีการทดสอบวัคซีนในกลุ่มอาสาสมัคร จำนวน 36 คน วันนี้ครบ 29 วัน หลังจากฉีดวัคซีนเข็มที่ 2 แล้ว ได้ผลออกมาเป็นที่น่ายินดี” ศ.นพ.สุทธิพงศ์ กล่าว
@ ChulaCOV-19 ไร้ผลข้างเคียงแรง สู้ 4 สายพันธุ์-กระตุ้นภูมิเท่า‘ไฟเซอร์’
ด้าน ศ.นพ.เกียรติ กล่าวถึงผลการทดสอบในมนุษย์ระยะแรกว่า จากการทดสอบอาสาสมัครระยะแรก ซึ่งเราแบ่งออกเป็น 2 กลุ่ม ได้แก่ กลุ่มบุคคลอายุระหว่าง 18-55 ปี จำนวน 36 คน และกลุ่มบุคคลอายุ 56-75 ปี ซึ่งในที่นี้จะขอกล่าวถึงผลการทดสอบของมนุษย์ในกลุ่มแรก (18-55 ปี) ส่วนกลุ่มที่สอง (56-75 ปี) นั้น อยู่ระหว่างการดำเนินการ ซึ่งขณะนี้ส่วนใหญ่ได้รับวัคซีนเข็มแรกแล้ว
ผลทดสอบความปลอดภัย ยังไม่พบผู้มีอาการข้างเคียงรุนแรงใดๆ มีเพียงผลข้างเคียงในระดับเล็กน้อยจนถึงปานกลางเท่านั้น คือ เจ็บบริเวณฉีดวัคซีน อ่อนเพลีย มีไข้ การหนาวสั่น และการปวดกล้ามเนื้อ ซึ่งส่วนใหญ่จะเกิดมากขึ้นในวัคซีนเข็มที่ 2
- สำหรับกลุ่มย่อยที่ฉีดวัคซีน ChulaCov-19 ปริมาณ 10 ไมโครกรัม พบว่าอาสาสมัครกลุ่มนี้มีอาการอ่อนเพลีย (Fatigue) อยู่ที่ 58%
- สำหรับกลุ่มย่อยที่ฉีดวัคซีน ChulaCov-19ปริมาณ 25 ไมโครกรัม พบว่าอาสาสมัครกลุ่มนี้มีไข้ (Fever) อยู่ที่ 17% มีอาการหนาวสั่น (Chills) อยู่ที่ 33% และมีอาการอ่อนเพลีย 50%
- สำหรับกลุ่มย่อยที่ฉีดวัคซีน ChulaCov-19ปริมาณ 50 ไมโครกรัม พบว่าอาสาสมัครกลุ่มนี้มีไข้ (Fever) อยู่ที่ 25% มีอาการหนาวสั่น (Chills) อยู่ที่ 42% และมีอาการอ่อนเพลีย 58%
“หากเปรียบเทียบผลรายงานของวัคซีนไฟเซอร์และวัคซีนโมเดอร์นา จะเห็นว่า การเกิดอาการไข้ในวัคซีนไฟเซอร์พบ 17% ใกล้เคียงกับวัคซีน ChulaCov-19ขณะที่วัคซีนโมเดอร์นาอยู่ที่ 40% ส่วนอาการหนาวสั่นวัคซีนไฟเซอร์อยู่ที่ 58% และวัคซีนโมเดอร์นาอยู่ที่ 80% และอาการอ่อนเพลีย วัคซีนไฟเซอร์อยู่ที่ 75% และวัคซีนโมเดอร์นาอยู่ที่ 80% ซึ่งผลดังกล่าวเป็นผลการวิจัยคนละงานวิจัย ไม่สามารถเปรียบเทียบโดยตรงได้ แต่เป็นข้อมูลให้รับทราบ” ศ.นพ.เกียรติ กล่าว
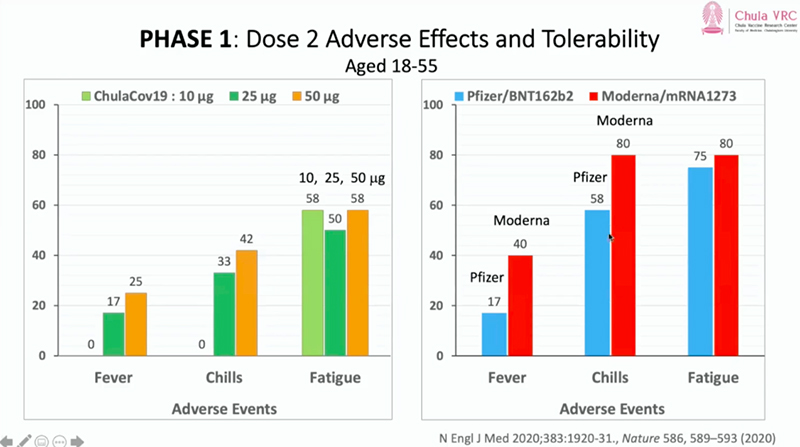 ภาพการเปรียบเทียบอาการข้างเคียงของวัคซีนจุฬาคอฟ 19 และวัคซีนชนิด mRNA ยี่ห้ออื่น
ภาพการเปรียบเทียบอาการข้างเคียงของวัคซีนจุฬาคอฟ 19 และวัคซีนชนิด mRNA ยี่ห้ออื่น
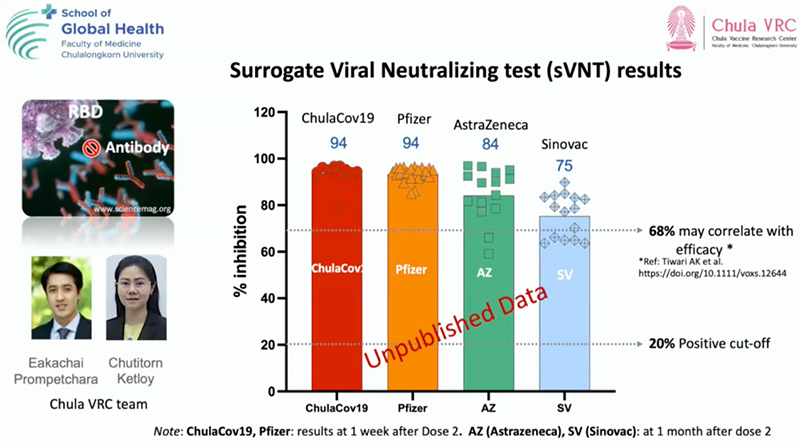 ภาพผลการกระตุ้นภูมิคุ้มกันถึงความสามารถในการยับยั้งการจับโปรตีน
ภาพผลการกระตุ้นภูมิคุ้มกันถึงความสามารถในการยับยั้งการจับโปรตีน
ผลการกระตุ้นภูมิคุ้มกัน : ความสามารถในการยับยั้งการจับโปรตีน พบว่าวัคซีน ChulaCov-19มีระดับการกระตุ้นภูมิคุ้มกันอยู่ที่ 94% เทียบเท่าวัคซีนไฟเซอร์ ขณะที่วัคซีนแอสตร้าเซนเนก้าอยู่ที่ 84% และซิโนแวค 75% อย่างไรก็ตามหากวัคซีนใดสามารถกระตุ้นภูมิคุ้มกันได้มากกว่า 68% คาดว่าจะมีประสิทธิภาพในการป้องกันการติดเชื้อได้
ผลการตรวจหาภูมิคุ้มกันในเลือด : ความสามารถในการยับยั้งไม่ให้เชื้อไวรัสเข้าเซลล์ พบว่า 3 สัปดาห์ หลังจากฉีดวัคซีน ChulaCOV-19 เข็มที่ 1 มีภูมิคุ้มกันอยู่ที่ 248 ซึ่งใกล้เคียงกับวัคซีนไฟเซอร์อยู่ที่ 281 ส่วนหลังจากฉีดวัคซีน ChulaCOV-19 เข็มที่ 2 ได้ 1 สัปดาห์ พบมีภูมิคุ้มกันอยู่ที่ 4,514 ขณะที่วัคซีนไฟเซอร์อยู่ที่ 1,742
ผลการป้องกันโควิด : ความสามารถในการยับยั้งเชื้อไวรัสข้ามสายพันธ์ุ พบว่าวัคซีน ChulaCOV-19 สามารถยับยั้งเชื้อโควิดสายพันธุ์อัลฟ่า (อังกฤษ) ได้ในระดับ 964 สายพันธุ์เบต้า (แอฟริกาใต้) ได้ในระดับ 343 สายพันธุ์แกมม่า (บราซิล) ได้ในระดับ 372 และสายพันธุ์เดลต้า (อินเดีย) ได้ในระดับ 977
ทั้งนี้หากเทียบความสามารถในการป้องกันโควิดในเชื้อกลายพันธุ์กับวัคซีนไฟเซอร์ พบว่า ChulaCOV-19มีความสามารถในการป้องกันสายพันธุ์เบต้า (แอฟริกาใต้) ในระดับ 343 ขณะที่วัคซีนไฟเซอร์ได้ในระดับ 16 และสามารถป้องกันสายพันธุ์เดลต้า (อินเดีย) ในระดับ 977 ขณะที่วัคซีนไฟเซอร์ได้ในระดับ 349
ผลการกระตุ้นภูมิคุ้มกันชนิด T-Cell : พบว่าสามารถกระตุ้นภูมิคุ้มกันชนิด T-Cell ได้ดี
"สรุปได้ว่าวัคซีน ChulaCOV-19สามารถกระตุ้นภูมิคุ้มได้เทียบเท่าวัคซีนชนิด mRNA เช่น ไฟเซอร์และโมเดอร์นา และสามารถป้องกันเชื้อข้ามกลายพันธุ์ 4 สายพันธุ์ คือ อัลฟ่า เบต้า แกมม่า และเดลต้า นอกจากนั้นยังช่วยกระตุ้นภูมิคุ้มกันชนิด T-Cell ซึ่งจะช่วยขจัดและควบคุมเชื้อที่อยู่ในเซลล์ของคนที่ติดเชื้อได้ด้วย โดยสามารถยับยั้งการจับของโปรตีนที่กลุ่มหนามได้ 94% คาดว่าจะสามารถป้องกันการติดเชื้อได้” ศ.นพ.เกียรติ กล่าว
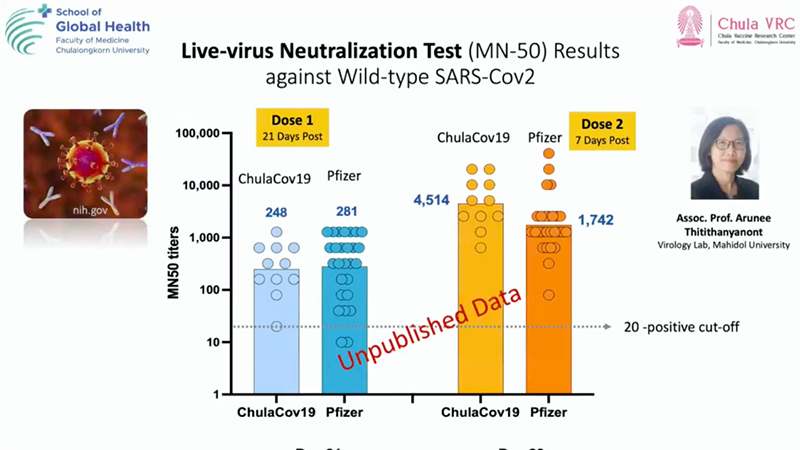 ภาพผลการตรวจหาภูมิคุ้มกันในเลือด: ความสามารถในการยับยั้งไม่ให้เชื้อไวรัสเข้าเซลล์
ภาพผลการตรวจหาภูมิคุ้มกันในเลือด: ความสามารถในการยับยั้งไม่ให้เชื้อไวรัสเข้าเซลล์
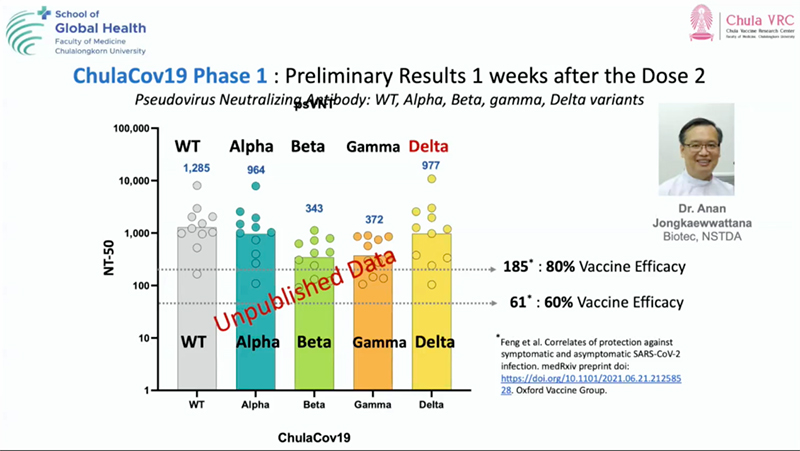 ภาพผลการป้องกันโควิด: ความสามารถในการยับยั้งเชื้อไวรัสข้ามสายพันธ์ุ
ภาพผลการป้องกันโควิด: ความสามารถในการยับยั้งเชื้อไวรัสข้ามสายพันธ์ุ
@ เก็บรักษาง่ายกว่า mRNA ยี่ห้ออื่น
นอกจากนั้นผลการทดสอบในหนูทดลองชนิดพิเศษ พบว่าเมื่อหนูได้รับการฉีดวัคซีน ChulaCOV-19ครบ 2 เข็ม ห่างกัน 3 สัปดาห์ แล้วให้หนูทดลองรับเชื้อโควิดทางจมูก สามารถป้องกันหนูทดลองไม่ให้ป่วยเป็นโรคและยับยั้งไม่ให้เชื้อไวรัสเข้าสู่กระแสเลือดได้ รวมทั้งสามารถลดเชื้อในจมูกและปอดไปอย่างน้อย 10 ล้านเท่า และเมื่อทดสอบความเป็นพิษ พบว่าปลอดภัยดี ส่วนหนูที่ไม่ได้รับวัคซีน จะเกิดอาการป่วยโควิดใน 3-5 วัน และทุกตัวมีเชื้อในกระแสเลือด ในจมูก และปอดจำนวนมาก
ไม่เพียงเท่านี้ ในการทดสอบความทนทานต่ออุณหภูมิของวัคซีน ChulaCOV-19ยังพบว่าวัคซีนสามารถเก็บอยู่ในตู้เย็นที่อุณหภูมิ 2-8 องศาเซลเซียส ได้นานถึง 3 เดือน และเก็บในอุณหภูมิห้องที่ 25 องศาเซลเซียสได้นาน 2 สัปดาห์ ทำให้การจัดเก็บรักษาง่ายกว่าวัคซีนโควิดชนิด mRNA ยี่ห้ออื่นมาก
@ เดินหน้าทดสอบระยะที่ 2 ในอาสาสมัคร 25 ส.ค.นี้
ศ.นพ.เกียรติ กล่าวอีกว่า ต่อจากนี้ในปลายสัปดาห์จะมีการประชุมหารือ เพื่อหาปริมาณของโดสที่จะใช้ในการดำเนินการขั้นต่อไป แต่การดำเนินการตอนนี้จะดำเนินงานทีละขั้นตอนไม่ได้ เนื่องจากต้องแข่งกับเวลา เราจึงแบ่งการทดสอบในมนุษย์ระยะที่ 2 ออกเป็น กลุ่มย่อย 2a และ 2b โดยในส่วนกลุ่มย่อย 2a จะมีการคัดกรองอาสาสมัคร 150 คน เพื่อทดสอบเปรียบเทียบระหว่างวัคซีน ChulaCOV-19 และวัคซีนไฟเซอร์ คาดเริ่ม 25 ส.ค.2564 ก่อนจะดำเนินการในส่วน 2b ต่อไป โดยจะใช้งบประมาณอยู่ที่ 500-600 ล้านบาท
ส่วนการการทดสอบในมนุษย์ระยะที่ 3 จะต้องดำเนินการหรือไม่นั้น ต้องอยู่ที่กติกาการขึ้นทะเบียนของสำนักงานคณะกรรมการอาหารและยา (อย.) ที่คาดว่าจะออกมาในเดือน เม.ย.นี้ ว่าสามารถขึ้นทะเบียนได้ในการทดลองในมนุษย์ระยะที่ 2 ได้เลยหรือไม่
@ คาดได้ใช้ ChulaCOV-19 เม.ย.65
สำหรับวัคซีนนี้คนไทยจะได้ใช้เมื่อไรนั้น ศ.นพ.เกียรติ กล่าวว่า คาดการณ์อย่างเร็วที่สุด เราจะได้ฉีดวัคซีน ChulaCov-19ในช่วงเม.ย.2565 แต่จะต้องได้รับความร่วมมือทั้ง 4 องค์ประกอบ ดังนี้
1.ต้องไม่ระดมทุนแบบเดิม คือต้องมีเป้าหมายร่วมกันทั้งภาครัฐ เอกชน และภาคประชาชน และต้องมีงบที่เพียงพอรวดเร็วและมีประสิทธิภาพ
2.ต้องมีกติกาในการขึ้นทะเบียนวัคซีนที่ชัดเจน ภายในเดือนหน้าจากสำนักงานคณะกรรมการอาหารและยา (อย.) ว่าการขึ้นทะเบียนจะต้องทำวิจัยระยะ 2b หรือระยะ 3 อย่างไรจึงจะเพียงพอ
3.โรงงานผลิต ต้องเร่งดำเนินการให้สามารถผลิตวัคซีนที่มีคุณภาพและจำนวนมากได้
4.นโยบายการจองและจัดซื้อวัคซีนล่วงหน้า ต้องมีความชัดเจน
@ คาดผลิตวัคซีนได้ปีละ 20 ล้านโดส
ศ.นพ.เกียรติ กล่าวเพิ่มเติมว่า ขณะนี้ได้มีการเตรียมโรงงานการผลิต โดยได้ดีลกับบริษัท ไบโอเนท-เอเชีย จำกัด ในประเทศไทย บริษัทผู้พัฒนาเทคโนโลยีการผลิตรองรับมาตั้งแต่ปีที่แล้ว ซึ่งหากผลการวิจัยสำเร็จตามแผน จะใช้โรงงานแห่งนี้ในการผลิตวัคซีน ChulaCov-19คาดว่าสามารถผลิตได้ปีละ 20 ล้านโดส
@ วัคซีนโควิด ‘HXP-GPOVac’ วิจัยในมนุษย์ยี่ห้อแรก
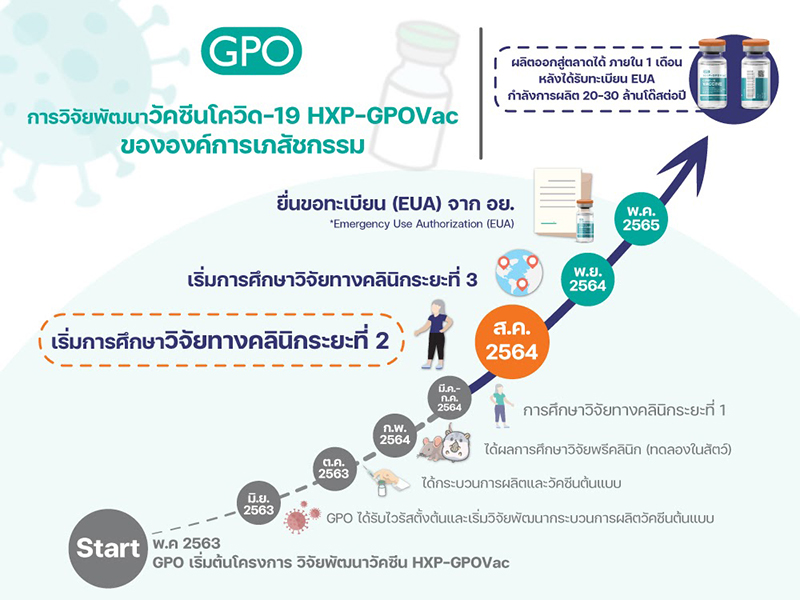
ส่วนวัคซีนโควิด ‘HXP-GPOVac’ ขององค์การเภสัชกรรม นพ.วิฑูรย์ ด่านวิบูลย์ ผู้อำนวยการองค์การเภสัชกรรม (อภ.) กล่าวว่า หลังจากที่องค์การเภสัชกรรมได้ดำเนินการวิจัยพัฒนากระบวนการผลิตวัคซีน และได้ผลิตวัคซีนป้องกันโควิดสำเร็จในขั้นแรก และนำเข้าสู่ขั้นตอนของการศึกษาวิจัยในมนุษย์ นับเป็นวัคซีนโควิดชนิดแรกของประเทศไทย ที่ได้วิจัยในมนุษย์
นพ.วิฑูรย์ กล่าวว่า วัคซีนโควิด HXP-GPOVac นั้นเป็นวัคซีนที่ได้รับการพัฒนาร่วมกับองค์กร PATH ที่ได้ส่งมอบหัวเชื้อวัคซีนต้นแบบ ซึ่งพัฒนาโดยโรงเรียนแพทย์ที่เมาท์ไซนาย (The Icahn School of Medicine at Mount Sinai) และมหาวิทยาลัยเท็กซัสที่ออสติน (University of Texas at Austin) ประเทศสหรัฐอเมริกา มาทำการผลิตที่โรงงานผลิตวัคซีนภายในโรงงานขององค์การฯ ที่ ต.ทับกวาง อ.แก่งคอย จ.สระบุรี ซึ่งได้มีการวิจัยพัฒนากระบวนการผลิตและสามารถผลิตวัคซีน HXP–GPOVac จากนวัตกรรมเชื้อตายชนิดลูกผสม (Inactivated chimeric vaccine) ด้วยเทคโนโลยีไข่ไก่ฟัก (Egg-based) เช่นเดียวกับการผลิตวัคซีนไข้หวัดใหญ่ได้
@ กระตุ้นภูมิคุ้มกันได้ดี
ด้าน ดร.ภญ.พรทิพย์ วิรัชวงศ์ หัวหน้าโครงการวัคซีน HXP–GPOVac องค์การเภสัชกรรม กล่าวว่า หัวเชื้อวัคซีนต้นแบบนี้ ได้พัฒนาจากนวัตกรรมการตัดต่อไวรัสนิวคาสเซิล (Newcastle disease virus, NDV) ให้มีการแสดงออกของโปรตีนหนามของไวรัสโคโรนาที่ได้ถูกปรับแต่งด้วยเทคโนโลยีเฮกซะโปร (HexaPro) ให้มีความคงตัวมากขึ้น มาใช้ในการกระตุ้นร่างกายให้สร้างภูมิคุ้มกันต้านโควิด เทคโนโลยีเฮกซะโปรนี้ ถูกพัฒนาที่มหาวิทยาลัยเท็กซัสที่ออสติน โดยนักวิจัยกลุ่มเดียวกับที่ได้พัฒนาโปรตีนหนามรุ่นแรกที่ใช้ในวัคซีนโควิด-19 อย่างน้อย 3 ชนิดที่มีการใช้อยู่ทั่วโลก โดยทั้งนี้องค์กร PATH ได้ส่งมอบหัวเชื้อไวรัส ให้แก่ 3 ผู้ผลิตวัคซีนในประเทศเวียดนาม ประเทศบราซิล รวมทั้งองค์การเภสัชกรรมของประเทศไทยด้วย
โดยขณะนี้การทดสอบวัคซีน HXP-GPOVac ในมนุษย์ระยะที่ 1 ได้ผลการวิเคราะห์ภูมิคุ้มกันหลังจากฉีดวัคซีนครบ 2 เข็ม 14 วันแล้ว ในอาสาสมัครกว่า 200 คนที่มีอายุไม่เกิน 60 ปี พบว่ากระตุ้นภูมิคุ้มกันสายพันธุ์ดั้งเดิม คือ สายพันธุ์อู่ฮั่นได้ และยังมีการศึกษาการกระตุ้นภูมิคุ้มกันอื่นๆ โดยเมื่อเรียงลำดับผลการกระตุ้นภูมิคุ้มกัน พบดังนี้ อู่ฮั่น อัลฟ่า เดลต้า แกมม่า และเบตา ตามลำดับ ทั้งนี้ในระยะต่อไปจะมีการศึกษากรณีการกระตุ้นภูมิเข็มที่ 3 หรือบูสเตอร์โดส
“จริงๆ ผลกระตุ้นภูมิคุ้มกันมาจากอาสาสมัคร มีการใช้โดสที่แตกต่างกัน ตั้งแต่ขนาดต่ำ กลาง และระดับสูง ซึ่งระดับสูงจะกระตุ้นภูมิเห็นชัดเจนกว่า และจัดการเชื้อกลายพันธุ์ได้ดีกว่า ส่วนระยะที่สองก็จะมีการศึกษาเพื่อยืนยันผลเหล่านี้ ทั้งการกระตุ้นภูมิคุ้มกัน และจัดการกับเชื้อกลายพันธุ์” ดร.ภญ.พรทิพย์ กล่าว
@ เดินหน้าทดสอบวัคซีนในมนุษย์ระยะที่ 2
เมื่อถามถึงการทดสอบวัคซีนในมนุษย์ระยะที่ 2 ดร.ภญ.พรทิพย์ กล่าวว่า ระยะที่สองนี้ เราจะศึกษาเรื่องความปลอดภัยเพิ่มเติม โดยเราจะเลือกสูตรที่คิดว่าได้ผลดี จึงต้องดูความปลอดภัยและผลการกระตุ้นภูมิคุ้มกัน และหลังจากการทดสอบในมนุษย์ระยะที่ 2 เสร็จแล้ว เราจะเลือกสูตรที่ใช้ในการทดสอบในมนุษย์ระยะที่ 3 ต่อไป โดยจะเป็นการเปรียบเทียบภูมิคุ้มกันกับวัคซีนชนิดอื่นที่มีการใช้ในท้องตลาด ว่า ประสิทธิภาพการกระตุ้นภูมิคุ้มกันต้องไม่ด้อยกว่า ซึ่งจะปรึกษากับ อย.เพิ่มเติมว่าต้องมีการศึกษาประสิทธิภาพในการป้องกันโรคด้วยหรือไม่ ซึ่งหากต้องก็จะใช้เวลาไปอีก แต่เราวางแผนการขึ้นทะเบียนวัคซีนแบบฉุกเฉิน โดยศึกษาระยะที่สามแบบกระตุ้นภูมิคุ้มกัน ก็จะสามารถทำได้ในประเทศไทย
สำหรับทดสอบวัคซีน HXP-GPOVac ในมนุษย์ระยะที่ 2 ขณะที่องค์การฯ ได้ยื่นผลการทดสอบในมนุษย์ระยะที่ 1 ให้ อย.แล้ว และได้รับการอนุมัติให้ดำเนินการวิจัยขั้นต่อไป ในวันนี้เราจึงพร้อมเดินหน้าศึกษาวิจัยในอาสาสมัคร จำนวน 250 คน ที่ขยายฐานอายุอยู่ที่ 18-75 ปีแล้ว ซึ่งคาดว่าผลการทดสอบในระยะที่ 2 จะออกมาในช่วงเดือน พ.ย.2564
@ คาดผลิตวัคซีนได้ปีละ 20-30 ล้านโดส เริ่มกลางปี 65
อย่างไรก็ตาม หากทดสอบวัคซีน HXP-GPOVac ในมนุษย์ครบทั้ง 3 ระยะ และได้รับการขึ้นทะเบียนตำรับ เพื่อใช้ในกรณีฉุกเฉิน (Emergency Use Authorization: EUA) จาก อย.สำเร็จ คาดว่าจะเริ่มผลิตได้ในกลางปี 2565 โดยจะสามารถผลิตได้ 20-30 ล้านโดสต่อปี และจะทำการขยายกำลังการผลิตอย่างต่อเนื่อง ในเบื้องต้นนี้วัคซีนสามารถรองรับการฉีดเพื่อป้องกันโควิดให้ชาวไทยได้ 10-15 ล้านคน
@ เตรียมทดสอบวัคซีนในเด็ก-คนท้อง
ส่วนจะมีแผนการทดสอบวัคซีนในเด็กด้วยหรือไม่นั้น ดร.ภญ.พรทิพย์ กล่าวว่า การทดลองในเด็กเป็นแผนที่จะมีต่อไป หลังจากการทดสอบในผู้สูงอายุแล้ว นอกจานั้นจะมีการทดสอบวัคซีนในหญิงตั้งครรภ์อีกด้วย พร้อมขอยืนยันว่าด้วยวัคซีนนี้ใช้เทคโนโลยีเชื้อตาย จึงถือว่ามีความปลอดภัยสูง

@ วัคซีนใบยา เริ่มวิจัยในมนุษย์ระยะที่ 1 ก.ย.นี้
สำหรับวัคซีน ‘ใบยา’ จากบริษัท ใบยา ไฟโตฟาร์ม จำกัด เมื่อวานนี้ เพจไทยคู่ฟ้าได้เปิดเผยว่า โรงงานต้นแบบการผลิตวัคซีนและยาชีววัตถุด้วยพืชโดยจุฬาลงกรณ์มหาวิทยาลัย และบริษัท ใบยา ไฟโตฟาร์ม จำกัด นั้น ปัจจุบัน มีความความคืบหน้ามาก และจะเริ่มต้นทดสอบในมนุษย์ ระยะที่ 1 ช่วงต้นเดือน ก.ย. นี้ หลังจากที่ผ่านการทดสอบในหนูทดลองและลิง พบว่าวัคซีนช่วยกระตุ้นภูมิคุ้มกันได้ดี
โดยเบื้องต้นจะทดสอบในอาสาสมัคร 100 คน แบ่งเป็น ขนาดโดส 10 ไมโครกรัม 50 ไมโครกรัม และ 100 ไมโครกรัม ทั้งนี้หากทุกอย่างเป็นไปตามแผน คาดว่าในไตรมาส 3 ของปี 2565 จะสามารถผลิตวัคซีนป้องกันโควิด จากฝีมือคนไทยได้ประมาณ 1 - 5 ล้านโดสต่อเดือน
ทั้งหมดนี้เป็นความคืบหน้าของสถานการณ์วัคซีนฝีมือคนไทย อันเป็นความมั่นคงของประเทศไทย ที่จะช่วยลดการนำเข้า และเป็นการพึ่งพาตนเองด้านวัคซีนของประเทศอย่างยั่งยืน
ข่าวอ่านประกอบ:
ผลทดสอบวัคซีน'ChulaCOV-19'เฟสแรก-ป้องกันโควิด 4 สายพันธุ์กระตุ้นภูมิเท่า'ไฟเซอร์' (4)
'วัคซีนใบยาสูบ' เตรียมทดสอบในคนเฟสแรก ก.ย.- วิจัยรุ่น 2 สู้โควิดทุกสายพันธุ์ (3)
ลุ้นผลิตกลางปี 65! วัคซีนโควิดสัญชาติไทย อภ.ทดสอบระยะ 1 ในมนุษย์ไร้ผลข้างเคียงรุนแรง (2)
ก้าวสำคัญสู่การพึ่งพาตนเอง! เปิดความคืบหน้าวิจัย'วัคซีน-ยาต้านโควิด'ของคนไทย (1)
#กดคลิก ติดตาม ส่งแชร์ข่าวอิศรา ได้ที่นี่ https://www.facebook.com/isranewsfanpage


 Isranews Agency | สำนักข่าวอิศรา
Isranews Agency | สำนักข่าวอิศรา