
การอนุมัติวัคซีนจากบริษัทไฟเซอร์ที่นครนิวยอร์กของสหรัฐอเมริกาและบริษัทไบโอเอ็นเทคจากประเทศเยอรมนีนั้น พบว่าวัคซีนนี้เป็นวัคซีนชนิดแรกที่มีการนำเสนอข้อมูลในขั้นต้นเมื่อวันที่ 9 พ.ย. ซึ่งบ่งชี้ว่าวัคซีนนั้นมีประสิทธิภาพในการป้องกันถึง 90 เปอร์เซ็นต์ และประมาณ 1 เดือนถัดมา ในวันที่ 11 ธ.ค. องค์การอาหารและยาของสหรัฐอเมริกาหรือ เอฟดีเอ ก็ได้อนุมัติให้ใช้งานวัคซีนชนิดนี้ได้โดยฉุกเฉิน ซึ่งถือว่าเป็นวัคซีนชนิดแรกที่ได้รับการอนุมัติให้มีการใช้งานได้โดยฉุกเฉินในสหรัฐอเมริกา
...................
สถานการณ์การแพร่ระบาดของเชื้อไวรัสโคโรน่าหรือโควิด 19 ในช่วงปลายปี 2563 ก้าวเข้าสู่ช่วงต้นปี 2564 ได้เกิดการแพร่ระบาดอย่างรุนแรงในหลายพื้นที่ทั่วโลก รวมถึงประเทศไทย ทำให้ประชาคมโลกยิ่งมีความคาดหวังมากว่า วัคซีน ที่มีการอนุมัติไปแล้ว และกำลังจะมีการอนุมัติในอนาคต จะสามารถยุติการแพร่ระบาดและนำวิถีชีวิตกลับมาสู่ช่วงเวลาก่อนที่จะมีการแพร่ระบาดของไวรัสโควิด-19 ได้
ล่าสุด สำนักข่าวนิวยอร์กไทม์ของสหรัฐฯ ได้ประมวลความคืบหน้าการพัฒนาวัคซีนทั่วโลกเอาไว้เป็นทางการ ซึ่งมีการอนุมัติทั้งแบบเป็นทางการ และแบบฉุกเฉินควบคู่กับการทดลองวัคซีนในระยะที่ 2 (ทดลองวัคซีนกับอาสาสมัครจำนวนร้อยคนขึ้นไป) และ ระยะที่ 3 (วัคซีนแก่อาสาสมัครจำนวนมากกว่าพันคนขึ้นไป)
มีรายละเอียดดังต่อไปนี้
@วัคซีนจากบริษัทไฟเซอร์และบริษัทไบโอเอ็นเทค
![]()
![]()
ชื่อวัคซีน: Comirnaty (ตั้งชื่อเมื่อ ม.ค. 2563)หรือรู้จักกันในชื่อ Tozinameranและชื่อ BNT162b2
ประสิทธิภาพ: 95%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 3 สัปดาห์
ลักษณะการใช้งาน: เก็บรักษาที่อุณหภูมิ -70 องศาเซลเซียส
สำหรับความเป็นมา เกี่ยวกับการอนุมัติวัคซีนจากบริษัทไฟเซอร์ที่นครนิวยอร์กของสหรัฐอเมริกาและบริษัทไบโอเอ็นเทคจากประเทศเยอรมนีนั้น พบว่าวัคซีนนี้เป็นวัคซีนชนิดแรกที่มีการนำเสนอข้อมูลในขั้นต้นเมื่อวันที่ 9 พ.ย. ซึ่งบ่งชี้ว่าวัคซีนนั้นมีประสิทธิภาพในการป้องกันถึง 90 เปอร์เซ็นต์ และประมาณ 1 เดือนถัดมา ในวันที่ 11 ธ.ค. องค์การอาหารและยาของสหรัฐอเมริกาหรือ เอฟดีเอ ก็ได้อนุมัติให้ใช้งานวัคซีนชนิดนี้ได้โดยฉุกเฉิน ซึ่งถือว่าเป็นวัคซีนชนิดแรกที่ได้รับการอนุมัติให้มีการใช้งานได้โดยฉุกเฉินในสหรัฐอเมริกา
โดยหลักการของวัคซีนชนิดนี้นั้นจะเป็นการยึดโยงกับโมเลกุลของยีนที่เรียกกันว่า mRNA ซึ่งวัคซีนนั้นจะบรรจุโครงสร้างยีนเพื่อจะออกคำสั่งให้มีการสร้างโปรตีนหนามซึ่งเป็นส่วนประกอบของไวรัสโคโรน่าขึ้นมา และพอเมื่อมีการฉีดวัคซีนนี้เข้าสู่เซลล์ วัคซีน Comirnaty ก็จะออกคำสั่งให้เซลล์นั้นสร้างโปรตีนหนามขึ้นมาเรื่อยๆในร่ายกาย โดยการกระทำเช่นนั้นก็จะเป็นการกระตุ้นให้ระบบป้องกันของร่างกายให้มีการตอบสนองต่อตัวไวรัสมากขึ้นไปอีก
สำหรับความคืบหน้าเกี่ยวกับการพัฒนาวัคซีนนั้น บริษัทไบโอเอ็นเทคได้ร่วมมือกับบริษัทไฟเซอร์ในช่วงเดือน มี.ค. เพื่อขยายวงการทดลองวัคซีนให้ใหญ่ขึ้น และได้เริ่มกระบวนการทดลองทางคลินิกหรือการทดลองการรักษาด้วยการฉีดในมนุษย์ในเดือน พ.ค. โดยพวกเขาได้ค้นพบว่าวัคซีน Comirnaty นั้นสามารถทำให้ร่างกายของอาสาสมัครทดลองวัคซีนผลิตสารภูมิคุ้มกันหรือแอนติบอดี้เพื่อจะต่อต้านไวรัส SARS-Cov-2 พร้อมกับผลิตเซลล์ภูมิคุ้มกันที่เรียกว่าทีเซลล์เพื่อจะตอบสนองกับไวรัส ต่อมาในวันที่ 27 ก.ค. บริษัทได้ประกาศที่จะดำเนินการทดลองทางคลินิกในขั้นตอนการทดลองทั้งระยะที่ 2 และระยะที่ 3 ควบคู่กันไปกับอาสาสมัครทั้งในประเทศสหรัฐอเมริกา และประเทศอื่นๆเช่นประเทศอาร์เจนติน่า ประเทศบราซิล และประเทศเยอรมนี และต่อมาเมื่อวันที่ 12 ก.ย. บริษัทไฟเซอร์และบริษัทไบโอเอ็นเทคได้ประกาศว่าพวกเขาจะดำเนินการทดลองกับอาสาสามัครจำนวน 44,000 รายในประเทศสหรัฐฯ
โดยตลอดช่วงฤดูร้อนถึงฤดูใบไม้ร่วง(มี.ค.-พ.ย.)ที่ผ่านมานั้น ทั่วทั้งโลกก็ได้ให้ความสนใจกับการทดลองของบริษัทไฟเซอร์-ไบโอเอ็นเทคมากขึ้นเรื่อยๆ ขณะที่ทางด้านของ นพ.อิลเบิร์ต โบว์ลาร์ ผู้บริหารของบริษัทไฟเซอร์ได้เคยให้สัมภาษณ์ว่าการทดลองวัคซีนในระยะที่ 3 จะได้ผลลัพท์โดยเร็วที่สุดในช่วงเดือน ต.ค.ที่ผ่านมา เพื่อจะชี้ชัดว่าวัคซีนนั้นสามารถใช้งานได้จริงหรือไม่ ขณะที่ทางด้านของนายโดนัลด์ ทรัมป์ ประธานาธิบดีสหรัฐฯได้ออกมากล่าวถึงความสำเร็จของการทดลองวัคซีน พร้อมกับยืนยันว่าวัคซีนจะสามารถใช้งานได้ก่อนวันเลือกตั้งประธานาธิบดีสหรัฐฯ (3 พ.ย. 2563) แต่ว่าเมื่อวันที่ 27 ต.ค. นพ.โบว์ลาร์ได้ยืนยันว่ายังคงมีข้อมูลที่ไม่เพียงพอเกี่ยวกับอาสาสมัครที่เข้าทดลองวัคซีน เพื่อจะกำหนดว่าวัคซีนนั้นสามารถใช้งานได้หรือไม่ และท้ายที่สุดเมื่อวันที่ 8 พ.ย. บริษัทไฟเซอร์และไบโอเอ็นเทคก็ได้ประกาศผลการทดลองเบื้องต้นจำนวน 94 เคส
และต่อมา ตลอดช่วงเดือน ธ.ค.บริษัทไฟเซอร์และไบโอเอ็นเทคได้ประกาศผลการทดลองเคยเพิ่มเติมอีก โดยในวันที่ 8 ธ.ค. เอฟดีเอก็ได้มีการประกาศผลการทดลองทางคลินิก โดยกำหนดว่าวัคซีน Comirnaty นั้นมีประสิทธิภาพอยู่ที่ 95 เปอร์เซ็นต์ โดยในช่วงระยะเวลาไม่เกิน 2 สัปดาห์หลังจากการฉีดวัคซีนโด๊สแรก วัคซีนจะสามารถคุ้มกันอาสาสมัครได้ และการฉีดวัคซีนในระยะเวลา 3 สัปดาห์หลังจากได้รับวัคซีนโด๊สแรกไปนั้น ก็จะเป็นการเสริมสร้างการทำงานของระบบภูมิคุ้มกันดังกล่าวนั่นเอง สำหรับผลอื่นๆของวัคซีนนั้น พบว่าวัคซีนได้แสดงผลที่แตกต่างกันเล็กน้อยมากในการทดลองกับอาสาสมัครซึ่งเป็นกลุ่มชาติพันธุ์ที่แตกต่างกันออกไป อาทิ กลุ่มคนดำ กลุ่มคนลาติโน่ และกลุ่มคนผิวขาว ขณะที่ผู้ซึ่งมีอาการทางสุขภาพ อาทิ เบาหวาน หรือผู้ที่ีมี้ำหนักเกินก็จะได้รับการปกป้องจากวัคซีนในระดับเดียวกันด้วยเช่นกัน
ในขณะที่ผู้สูงอายุซึ่งได้รับวัคซีนไปนั้นก็พบว่าวัคซีนได้แสดงผลซึ่งมีประสิทธิภาพเช่นเดียวกับผู้ที่ได้รับวัคซีนซึ่งอยู่ในวัยต่ำกว่า 65 ปี โดยวัคซีน Comirnaty นั้นไม่ทำให้เกิดผลข้างเคียงที่รุนแรงแต่อย่างใด นอกเสียจากอาการเหนื่อยล้าชั่วคราว มีไข้และปวดเมื่อยกล้ามเนื้อ
โดยผลการทดลองที่น่าประทับใจดังกล่าวนีนั้นทำให้เกิดการอนุมัติการใช้งานวัคซีนดังกล่าวไปทั่วโลก โดยวันที่ 2 ธ.ค. ประเทศอังกฤษได้มีการอนุมัติการใช้งานฉุกเฉินสำหรับวัคซีนจากบริษัทไฟเซอร์-ไบโอเอ็นเทค จึงทำให้วัคซีนดังกล่าวนั้นเป็นวัคซีนชนิดแรกที่ได้รับการอนุมัติให้มีการใช้งานในประเทศตะวันตกอย่างเป็นทางการ ซึ่งการฉีดวัคซีนนั้นได้เริ่มต้นขึ้นเมื่อวันที่ 8 ธ.ค. โดยมีนายวิลเลี่ยม เชคสเปียร์ อายุ 81 ปี อยู่ในกลุ่มแรกๆที่ได้รับการฉีดวัคซีน และต่อมาในวันที่ 11 ธ.ค. ก็มีการอนุมัติการใช้งานวัคซีนฉุกเฉินในสหรัฐอเมริกา และพอมาถึงวันที่ 13 ธ.ค.ก็มีการเริ่มกระบวนการจัดส่งวัคซีนใส่ลงไปในรถบรรทุกเพื่อที่จะกระจายวัคซีนไปทั่วสหรัฐอเมริกา พร้อมกับมีการวางแผนการแรกเกี่ยวกับการฉีดวัคซีนในวันถัดมา ซึ่งในช่วงสัปดาห์แรกที่มีการอนุมัติวัคซีนนั้นปรากฎว่ามีการกระจายวัคซีนไปแล้วกว่า 2.9 ล้านโด๊ส
ขณะที่ประเทศอื่นๆก็เริ่มทยอยที่จะอนุมัติการใช้งานวัคซีน Comirnaty มากขึ้นเรื่อยๆ อาทิประเทศอาร์เจนติน่า,ประเทศชิลี,ประเทศคอสตาริก้า,ประเทศเอกวาดอร์,ประเทศคูเวต,ประเทศเม็กซิโก,ประเทศปานามา และประเทศสิงคโปร์ ขณะที่สหภาพยุโรปก็ได้มีการเซ็นสัญญาจัดหาวัคซีนในวันที่ 21 ธ.ค. ส่วนประเทศบาห์เรน,ประเทศแคนาดา,ประเทศซาอุดิอาระเบียและประเทศสวิตเซอร์แลนด์ก็ได้มีการอนุมัติการใช้งานวัคซีนเต็มรูปแบบ
สำหรับกระบวนการแจกจ่ายวัคซีน Comirnaty ไปทั่วโลกนั้นจะดำเนินการภายใต้ข้อตกลงว่าบริษัทจะเริ่มกระบวนการแจกจ่ายไปยังประเทศต่างๆทั่วโลก โดยจะเริ่มกระบวนการได้ในช่วงฤดูร้อน (มี.ค.) ที่จะมาถึงนี้
ซึ่งเมื่อเดือน ก.ค.ที่ผ่านมาทีมที่ปรึกษาของประธานาธิบดีทรัมป์ได้ให้เงินสนับสนุนเป็นจำนวนทั้งสิ้น 1.9 พันล้านดอลลาร์สหรัฐฯ (56,977,200,000 บาท) สำหรับการทำสัญญาจัดหาวัคซีนล่วงหน้าจำนวนกว่า 100 ล้านโด๊ส และในเดือนเดียวกันนั้นบริษัทไฟเซอร์และไบโอเอ็นเทคก็ได้บรรลุข้อตกลงที่จะจัดส่งวัคซีนจำนวนกว่า 100 ล้านโด๊สภายในช่วงเดือน ก.ค. 2564 ขณะเดียวกันประเทศญี่ปุ่นก็ได้มีการทำข้อตกลงจัดหาวัคซีนจำนวนกว่า 120 ล้านโด๊ส,สหภาพยุโรปหรืออียูก็ได้มีการทำข้อตกลงว่าจะจัดหาวัคซีนจำนวน 300 ล้านโด๊ส และต่อมาเมื่อวันที่ 16 ธ.ค.บริษัทไบโอเอ็นเทคได้ประกาศข้อตกลงว่าจะจัดส่งวัคซีนจำนวนกว่า 100 ล้านโด๊สไปให้กับประเทศจีน ซึ่งการประกาศข้อตกลงดังกล่าวนั้นก็ทำให้วัคซีน Comirnaty กลายเป็นวัคซีนจากประเทศตะวันตกชนิดแรกที่มีการจำหน่ายในประเทศจีน
โดยบริษัทไฟเซอร์และบริษัทไบโอเอ็นเทคได้ประกาศเป้าหมายโดยคาดว่าจะผลิตวัคซีนให้ได้อย่างน้อย 1.3 พันล้านโด๊สภายในสิ้นปี 2564
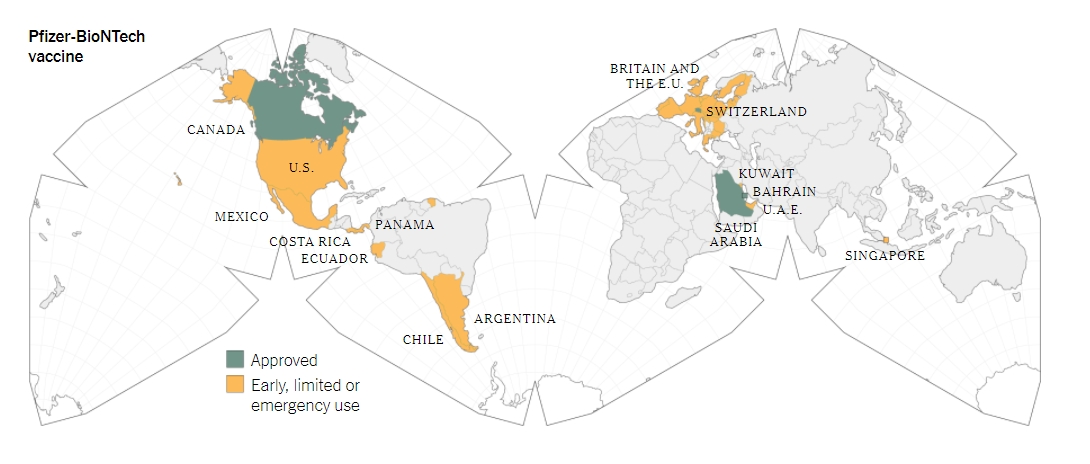
ประเทศที่มีการอนุมัติวัคซีนเต็มรูปแบบ (สีเขียว) และประเทศที่มีการอนุมัติการใช้งานวัคซีนขั้นต้น หรือการใช้งานแบบฉุกเฉิน (สีส้ม)
@วัคซีนจากบริษัทโมเดอร์นาและสถาบันสุขภาพแห่งชาติสหรัฐฯ
![]()
![]()
ชื่อวัคซีน:mRNA-127.3
ประสิทธิภาพ:94.5%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 4 สัปดาห์
ลักษณะการใช้งาน:เก็บรักษาที่อุณหภูมิ -20 องศาเซลเซียส ได้เป็นระยะเวลานาน 6 เดือน และสามารถเก็บรักษาที่ตู้เย็นทั่วไปได้เป็นระยะเวลานาน 30 วัน
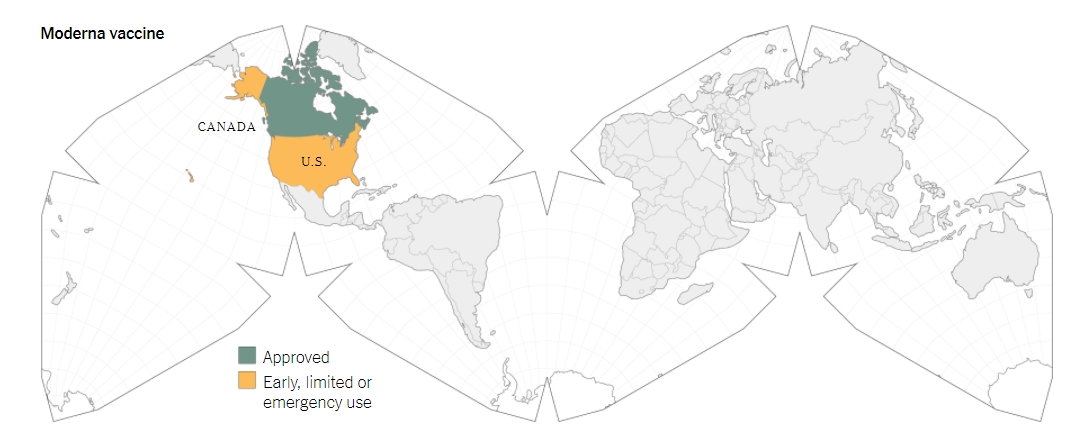
เมื่อวันที่ 18 ธ.ค.ที่ผ่านมา เอฟดีเอได้อนุมัติฉุกเฉินวัคซีนจากบริษัทในนครบอสตันซึ่งมีชื่อว่าโมเดอร์นา โดยการตัดสินใจอนุมัติดังกล่าวนั้นเปิดทางให้มีการเริ่มกระบวนการแจกจ่ายวัคซีน 5.9 ล้านโดสไปทั่วสหรัฐฯในช่วงสุดสัปดาห์ของวันดังกล่าว โดยวัคซีนจากบริษัทโมเดอร์นานั้นถือเป็นวัคซีนชนิดที่ 2 ซึ่งได้รับการอนุมัติในประเทศสหรัฐฯหลังจากที่มีการอนุมัติวัคซีนจากบริษัทไฟเซอร์และบริษัทไบโอเอ็นเทคไปแล้วเมื่อวันที่ 11 ธ.ค. และต่อมาเมื่อวันที่ 23 ธ.ค. ประเทศแคนาดาก็ให้การอนุมัติวัคซีนจากบริษัทโมเดอร์นา
สำหรับการทำงานของวัคซีนจากบริษัทโมเดอร์นานั้นจะเหมือนกับวัคซีนจากบริษัทไฟเซอร์และบริษัทไบโอเอ็นเทค โดยจะใช้วัคซีนประเภท mRNA ซึ่งก่อนหน้านี้นั้นบริษัทโมเดอร์นาได้มีการทดลองวัคซีน mRNA เอาไว้แล้วกับโรคหลายชนิดด้วยกัน แต่ว่าพวกเขาก็ยังไม่เคยนำเอาวัคซีนเหล่านี้เข้าสู่ท้องตลาดเลย ขณะที่การพัฒนาวัคซีน mRNA ของบริษัทโมเดอร์นานั้นก็ได้เริ่มมีการพัฒนาขึ้นในช่วงเดือน ม.ค.
ส่วนทางด้านรัฐบาลสหรัฐฯเองก็ได้มีการสนับสนุนเงินทุนให้บริษัทโมเดอร์นาเป็นจำนวนทั้งสิ้น 1 พันล้านดอลลาร์สหรัฐฯ(29,988,000,000 บาท) พร้อมกับการเป็นหุ้นส่วนร่วมกันวิจัยวัคซีนโดยสถาบันสุขภาพแห่งชาติสหรัฐฯ ซึ่งจากการวิจัย พวกเขาก็พบว่าวัคซีนนั้นมีความสามารถในการป้องกันลิงไม่ให้ติดไวรัสโคโรน่า และต่อมาในช่วงเดือน มี.ค. นักวิทยาศาสตร์ก็ได้มีการเอาวัคซีนของบริษัทไปเริ่มกระบวนการทดลองในมนุษย์ ซึ่งหลังจากการทดลองในมนุษย์ประสบความสำเร็จในเบื้องต้น ก็ได้มีการทดลองทางคลินิกในระยะ 3 โดยเริ่มตั้งแต่วันที่ 27 ก.ค.
ในวันที่ 16 พ.ย.บริษัทโมเดอร์นาได้ประกาศผลการทดลองทางคลินิกเบื้องต้น ก่อนจะมีการเก็บข้อมูลได้อย่างสมบูรณ์ในวันที่ 30 พ.ย. ด้วยจำนวนเคสทดลองทั้งสิ้น 196 เคสจากกลุ่มอาสาสมัครโดยมีกลุ่มอาสาสมัครจำนวน 185 รายได้รับยาหลอกหรือที่เรียกกันว่า placebo และมีรายงานว่ามีผู้ได้รับการฉีดวัคซีนจำนวน 11 รายได้รับเชื้อไวรัสโควิด-19 ด้วยเช่นกัน ซึ่งทั้งหมดนั้นก็ไม่ได้แสดงอาการที่รุนแรงจากไวรัสแต่อย่างใด ดังนั้นนักวิจัยจึงได้ประเมินว่าวัคซีนจะมีประสิทธิภาพอยู่ที่ 94.1 เปอร์เซ็นต์ ซึ่งถือว่าสูงกว่าที่ผู้เชี่ยวชาญได้คาดการณ์เอาไว้ในตอนที่เริ่มต้นการทดสอบวัคซีน
อย่างไรก็ตาม ณ เวลานี้ยังไม่มีความชัดเจนว่าประสิทธิภาพของวัคซีนจะอยู่ได้นานเท่าไร แต่ทางด้านของบริษัทโมเดอร์นาก็ได้ค้นพบว่าหลังจากการฉีดวัคซีนผ่านไปแล้วเป็นระยะเวลา 3 เดือน อาสาสมัครยังคงมีภูมิคุ้มกันที่แข็งแรง จึงทำให้ในวันที่ 2 ธ.ค. ทางบริษัทโมเดอร์นาได้มีการลงทะเบียนเพื่อดำเนินการทดสอบวัคซีนกับผู้เยาว์ซึ่งมีช่วงอายุตั้งแต่ 12-18 ปี
ขณะที่ในด้านของธุรกิจนั้นก็มีรายงานว่าบริษัทโมเดอร์นาได้แพ้คดีสิทธิบัตรเทคโนโลยีวัคซีนในช่วงเดือน ก.ค.ที่ผ่านมา จึงทำให้ในเดือนเดียวกันนั้นเอง บริษัทได้ออกมาระบุว่าตัวบริษัทเองก็ไม่มั่นใจเหมือนกันว่าจะเป็นบริษัทแห่งแรกที่ได้คิดนวัตกรรมวัคซีน mRNA ซึ่งใช้ในวัคซีนโรคต่างๆของบริษัทรวมไปถึงวัคซีนสำหรับโรคโควิด-19หรือไม่ ขณะเดียวกันนั้นเองบริษัทก็ได้เริ่มมีการทำข้อตกลงกับประเทศต่างๆเพื่อที่จะจัดส่งวัคซีนทันทีที่ได้รับการอนุมัติ โดยในวันที่ 11 ส.ค. รัฐบาลสหรัฐฯก็ได้มีการให้เงินบริษัทอีก 1.5 พันล้านดอลลาร์สหรัฐฯ (44,982,000,000 บาท) เพื่อแลกกับการที่บริษัทจะจัดส่งวัคซีนอีกจำนวน 100 ล้านโด๊ส ถ้าหากวัคซีนได้รับการพิสูจน์ว่ามีความปลอดภัยและมีประสิทธิภาพ และต่อมาในเดือน ธ.ค.ก็มีการทำข้อตกลงกันอีกครั้งกับบริษัทโมเดอร์นาเพื่อให้มีการจัดส่งวัคซีนจำนวน 100 ล้านโด๊สในช่วงไตรมาสที่ 2 ของปี 2564
ส่วนในประเทศอื่นๆนั้น ก็มีรายงานว่าเมื่อวันที่ 25 พ.ย. บริษัทโมเดอร์นาได้บรรลุข้อตกลงกับคณะกรรมการยุโรป ในการที่จะส่งวัคซีนจำนวน 160 ล้านโดส และบริษัทโมเดอร์นายังได้ทำข้อตกลงที่มีลักษณะคล้ายๆกันกับประเทศอื่นๆอีก อาทิ ประเทศแคนาดา,ประเทศญี่ปุ่น,ประเทศการ์ต้า,และประเทศเกาหลีใต้
@วัคซีนจากสถาบันกามาเลยาของรัสเซีย
![]()
ชื่อวัคซีน:สปุตนิก 5 (ชื่อทางการ Gam-Covid-Vac)
ประสิทธิภาพ:91.4%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 3 สัปดาห์
ลักษณะการใช้งาน:สามารถเก็บรักษาได้ในตู้แช่แข็ง และมีการพัฒนาสูตรผสมวัคซีนซึ่งสามารถเก็บได้ในตู้เย็น
สถานบันกามาเลยา ซึ่งเป็นส่วนหนึ่งของกระทรวงสาธารณสุขของรัสเซียได้ออกประกาศเมื่อวันที่ 14 ธ.ค.ที่ผ่านมา ว่าสามารถสร้างวัคซีนซึ่งมีอัตราประสิทธิภาพสูงถึง 91.4 เปอร์เซ็นต์
โดยวัคซีนของสถาบันกามาเลยานั้นจะเป็นการผสมผสานอะดีโนไวรัส (จุลินทรีย์ไวรัสขนาดเล็กขนาดกลางที่มีนิวเคลียส สายดีเอ็นเอเกลียวคู่เดี่ยว)จำนวน 2 ชนิดได้แก่ Ad5 และ Ad26 ซึ่งที่ผ่านมานั้นได้มีการทดสอบอะดีโนไวรัส 2 ชนิดนี้เพื่อจะใช้ในการทำวัคซีนมาเป็นเวลานานหลายปีแล้ว และนักวิทยาศาสตร์รัสเซียก็ได้คาดหวังว่าการผสมผสานอะดีโนไวรัสทั้ง 2 ชนิด จะทำให้ระบบภูมิคุ้มกันของร่างกายไม่จดจำวัคซีนว่าเป็นวัตถุแปลกปลอมที่ต้องถูกทำลาย
นักวิทยาศาสตร์ได้มีการเริ่มกระบวนการทดลองทางคลินิกในช่วงเดือน มิ.ย.ที่ผ่านมา ขณะที่นายวลาดิเมียร์ ปูติน ประธานาธิบดีรัสเซียได้ประกาศเมื่อวันที่ 11 ส.ค.ว่าหน่วยงานกำกับดูแลด้านสาธารณสุขของรัสเซียได้อนุมัติวัคซีนและตั้งชื่อวัคซีนนี้ว่าสปุตนิก 5 ก่อนที่จะมการดำเนินการทดลองทางคลินิกในระยะที่ 3 ขณะที่ผู้เชี่ยวชาญด้านวัคซีนได้ออกมาวิพากษ์วิจารณ์ว่าการดำเนินการของรัสเซียนั้นเสี่ยงมาก และในเวลาต่อมาประเทศรัสเซียก็ได้มีการแก้ไขประกาศดังกล่าว โดยระบุว่าการอนุมัติที่ผ่านมานั้นเป็นแค่การละทะเบียนใบรับรองตามเงื่อนไขเท่านั้น และจะต้องผลการวิจัยซึ่งเป็นบวกในกระบวนการทดลองทางคลินิกในระยะที่ 3 เสียก่อน โดยนอกเหนือจากการหาอาสาสมัครในประเทศรัสเซียแล้ว ก็ยังมีการหาอาสาสมัครในประเทศต่างๆ อาทิ ประเทศเบลารุส ประเทศสหรัฐอาหรับเอมิเรตส์ และประเทศเวเนซูเอลา และต่อมาเมื่อวันที่ 17 ต.ค. ก็มีการดำเนินการอนุมัติการทดลองคลินิกทั้งระยะ 2 และ 3 ในประเทศอินเดีย
ในวันที่ 4 ก.ย. 3 สัปดาห์หลังจากที่มีประกาศจากนายปูติน สถาบันกามาเลยาก็ได้ตีพิมพ์ผลการทดลองทางคลินิกในระยะที่ 1/2 ที่พบในกลุ่มอาสาสมัครทดลองวัคซีน ซึ่งระบุว่าวัคซีนสปุตนิก 5 นั้นก่อให้เกิดการผลิตสารภูมิคุ้มกันสำหรับไวรัสโคโรน่า และมีผลข้างเคียงที่น้อยมาก
ต่อมาวันที่ 11 ก.ย. กองทุนความมั่งคั่งรัสเซียได้ประกาศหลักฐานการทดลองเบื้องต้นฉบับแรก จากการทดลองทางคลินิกในระยะที่ 3 ซึ่งบ่งชี้ว่าวัคซีนนั้นมีประสิทธิภาพ โดยยึดโยงข้อมูลจากเคสจำนวน 20 เคสของผู้เข้าร่วมการทดลอง โดยนักวิทยาศาสตร์รัสเซียคาดการณ์ว่าวัคซีนได้แสดงประสิทธิภาพออกมาอยู่ที่ 92 เปอร์เซ็นต์ และพอมาถึงเดือน ธ.ค. การทดลองทางคลินิกก็ได้ผลทดลองสุดท้ายรวมทั้งสิ้น 78 เคส ด้วยอัตราประสิทธิภาพของวัคซีนอยู่ที่ 91.4 เปอร์เซ็นต์ โดยจาก 78 เคสที่มีการทดลองทางคลินิกนั้นพบว่ามีอยู่ 20 เคสที่มีอาการอย่างรุนแรง ซึ่งภายหลังได้มีการเปิดเผยว่าทั้ง 20 เคสนั้นเป็นเคสที่ได้รับยาหลอกหรือก็คือไม่ได้รับวัคซีนจริงๆนั่นเอง และในเวลาต่อมา นักวิทยาศาสตร์ก็ได้ประกาศว่าไม่พบผลข้างเคียงที่รุนแรงจากวัคซีนแต่อย่างใด ซึ่งทำให้ในวันที่ 26 ธ.ค. ผู้ที่ดำเนินการผลิตวัคซีนสปุตนิก 5 ได้ออกมาทวีตว่าพวกเขาค้นพบว่า วัคซีนนั้นยังคงมีประสิทธิภาพเกินกว่า 90 เปอร์เซ็นต์ เมื่อมีการทดลองกับผู้ที่มีอายุเกิน 60 ปีขึ้นไป
อนึ่งในเดือน พ.ย.ที่ผ่านมานั้นรัสเซียได้เริ่มกระบวนการแจกจ่ายวัคซีนสปุตนิก 5 ครั้งใหญ่ภายในประเทศรัสเซีย แต่ด้วยความกังวลว่าการเร่งอนุมัติวัคซีน จะทำให้สาธารณชนเกิดความลังเลใจไปทั่วประเทศรัสเซีย จึงทำให้ต้องมีการทดลองและเก็บข้อมูลวัคซีนควบคู่กันไป แต่ว่าเมื่อวันที่ 24 ธ.ค. สำนักข่าวเอพีก็ได้รายงานว่าอาสาสมัครทดลองวัคซีนที่ต้องสงสัยว่าจะได้รับยาหลอกนั้นกลับถูกกีดกันไม่ให้รับวัคซีนซึ่งกำลังแพร่หลายไปทั่วประเทศรัสเซีย ขณะที่ผู้ดำเนินการวิจัยวัคซีนก็ได้ลดกลุ่มการทดลองทางคลินิกในระยะที่ 3 ลงจากที่เคยตั้งเป้าไว้ว่าจะทดลอง 40,000 คน ก็เหลืออยู่แค่ 31,000 คนเท่านั้น ซึ่งนี่ก็ยิ่งทำให้ผู้เชี่ยวชาญมีความกังวลว่าการลดจำนวนเป้าทดลองนั้นจะทำให้ไม่มีข้อมูลทางสถิติเพียงพอที่จะทำให้ได้ข้อสรุปเกี่ยวกับประสิทธิภาพและความปลอดภัยของวัคซีน ซึ่งจนถึง ณ เวลานี้ ก็ยังไม่มีการตีพิมพ์ผลการทดลองเต็มรูปแบบลงบนวารสารทางการแพทย์แต่อย่างใด
และในเดือน ธ.ค.ก็มีสิ่งที่ไม่เคยเกิดขึ้นมาก่อนในกระบวนการทดลองวัคซีนสำหรับไวรัสโคโรน่า เมื่อสถาบันกามาเลยาได้ร่วมมือกับบริษัทแอสตร้าเซนเนก้าซึ่งทำวัคซีนจากอะดีโนไวรัสเหมือนกัน โดยผู้ผลิตวัคซีนทั้ง 2 รายนั้นได้รวมกระบวนการทดลองวัคซีนเข้าไว้ด้วยกัน เพื่อจะหาข้อสรุปว่าการวมวัคซีนนั้นจะทำให้ได้ภูมิคุ้มกันที่ยาวนานกว่าการใช้วัคซีนแค่ชนิดเดียวในกระบวนการฉีดวัคซีนทั้ง 2 โด๊สหรือไม่ โดยบริษัทแอสตร้าเซนเนก้าได้เริ่มกระบวนการทดลองวัคซีนแบบผสมที่ว่านี้ครั้งแรกเมื่อวันที่ 24 ธ.ค.ที่ผ่านมา
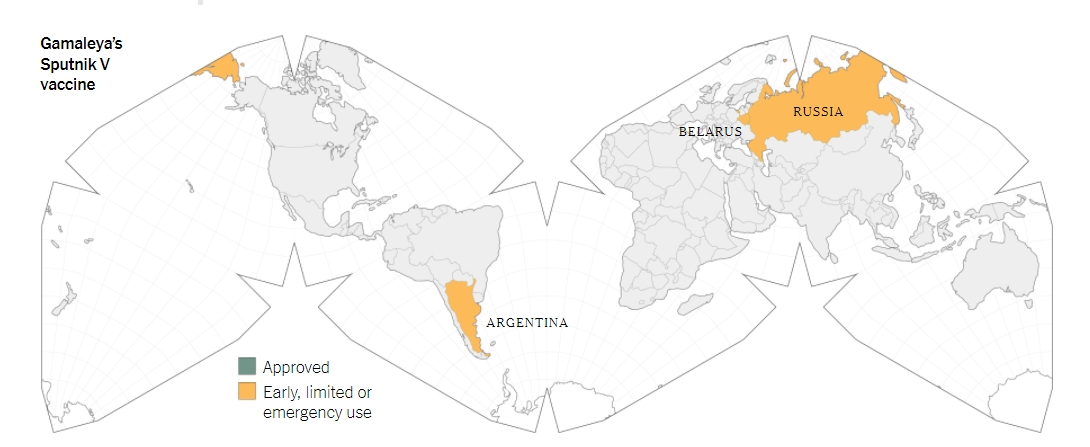
โดยนับตั้งแต่ช่วง ต.ค.ที่ผ่านมานั้น ประเทศรัสเซียก็ได้มีการเจรจากับหลายประเทศเพื่อจะบรรลุข้อตกลงการส่งวัคซีนสปุตนิก 5 ซึ่งประเทศเหล่านั้นก็ได้แก่ประเทศบราซิล, ประเทศอินเดีย, ประเทศเม็กซิโก และประเทศเวเนซุเอลา และเมื่อวันที่ 22 ธ.ค.ที่ผ่านมานั้นเอง ประเทศเบลารุสก็ได้เป็นประเทศแรกที่มีการลงทะเบียนรับรองวัคซีนสปุตนิก 5 นอกประเทศรัสเซีย และในวันถัดมา ประเทศอาร์เจนติน่าก็ได้อนุมัติฉุกเฉินให้ดำเนินการใช้วัคซีนสปุตนิก 5 เช่นกัน
@วัคซีนจากบริษัทแอสตร้าเซนเนก้าและมหาวิทยาลัยออกซ์ฟอร์ด
![]()
![]()
ชื่อวัคซีน:AZD1222 (ในประเทศอินเดียใช้ชื่อว่า Covishield)
ประสิทธิภาพ: ไม่ต่ำกว่า 90%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 4 สัปดาห์
ลักษณะการใช้งาน:เก็บรักษาที่อุณหภูมิตู้เย็นทั่วไป โดยจะคงที่เป็นระยะเวลาอย่างน้อย 6 เดือน
เมื่อวันที่ 8 ธ.ค. นักวิจัยจากมหาวิทยาลัยออกซ์ฟอร์ดและจากบริษัทสัญชาติอังกฤษ-สวีเดนที่ชื่อว่าแอสตร้าเซนเนก้าได้เผยแพร่ผลวิจัยทางวิทยาศาสตร์ฉบับแรกเกี่ยวกับการทดลองทางคลินิกของวัคซีนในระยะที่ 3 ซึ่งผลการทดลองดังกล่าวนั้นแสดงให้เห็นว่าวัคซีนสามารถจะปกป้องมนุษย์จากไวรัสโควิด-19 ได้ แต่ก็ยังคงมีคำถามมากมายที่ไม่ได้รับคำตอบเกี่ยวกับข้อสรุปการทดลอง
ในช่วงต้นของการระบาดนักวิทยาศาสตร์ที่มหาวิทยาลัยออกซ์ฟอร์ดได้เริ่มการพัฒนาวัคซีนด้วยการดัดแปลงพันธุกรรมอะดีโนไวรัสซึ่งมีคุณสมบัติในการติดเชื้อลิงชิมแปนซี โดยหลังจากที่มีการฉีดวัคซีนเข้าไปในลิงชิมแปนซี นักวิทยาศาสตร์ก็พบว่าวัคซีนนั้นสามารถป้องกันไม่ให้สัตว์ติดเชื้อไวรัสได้ ต่อมาในช่วงเดือน เม.ย.จึงได้มีการเริ่มการทดลองวัคซีนในมนุษย์หรือการทดลองทางคลินิกในระยะที่1/2 ซึ่งการทดลองในคลินิกดังกล่าว ผู้พัฒนาวัคซีนก็ยังไม่พบผลข้างเคียงที่ร้ายแรงจากการทดลองวัคซีนแต่อย่างใดจึงทำให้มีการทดลองในระยะที่ 2/3 ในประเทศบราซิล,ประเทศแอฟริกาใต้ และประเทศสหรัฐอเมริกาในเวลาต่อมา
พอมาถึงวันที่ 6 ก.ย. บริษัทแอสตร้าเซนเนก้าก็จำเป็นต้องหยุดการทดลองวัคซีนทั่วโลกเอาไว้ก่อนเนื่องจากพบว่าอาสาสมัครทดลองวัคซีนรายหนึ่งเกิดอาการไขสันหลังอักเสบ แต่ว่าไม่เกิน 1 สัปดาห์หลังจากนั้น การทดลองวัคซีนก็กลับมาดำเนินการอีกครั้งในทุกประเทศยกเว้นที่ประเทศสหรัฐอเมริกา และต่อมาเมื่อถึงวันที่ 21 ต.ค. ก็มีรายงานจากหนังสือพิมพ์ในประเทศบราซิลว่ามีอาสาสมัครทดลองวัคซีนรายหนึ่งเสียชีวิตจากไวรัสโควิด-19 ซึ่งทางด้านแอสตร้าเซนเนก้าก็ไม่ได้มีแถลงการณ์ในกรณีนี้แต่อย่างใด ในขณะที่การทดลองการรักษาในประเทศบราซิลยังคงดำเนินต่อไป พร้อมกับการเผยแพร่คำชี้แจงว่าผู้ที่เสียชีวิตนั้นเป็นอาสาสมัครที่ได้รับยาหลอก และพอมาถึงวันที่ 23 ต.ค. เอฟดีเอก็ได้มีการอนุมัติให้เริ่มต้นการทดลองวัคซีนในประเทศสหรัฐฯอีกครั้งหนึ่ง
ในวันที่ 19 พ.ย. นักวิจัยก็ได้เผยแพร่ผลการทดลองทางคลินิกระยะ 2/3 ในประเทศอังกฤษ พร้อมกับระบุว่าจะต้องมีการทำการทดลองต่อไปเพื่อดูว่าปัจจัยด้านอายุที่แตกต่างกันนั้นจะส่งผลต่อวัคซีนหรือไม่ ดังนั้นจึงมีการเริ่มการทดลองกับอาสาสมัครจำนวน 160 คน ซึ่งเป็นผู้มีอายุตั้งแต่ 18-55 ปี,อาสาสมัครจำนวน 160 คน ซึ่งมีอายุตั้งแต่ 56-69 ปี และ อาสาสมัครจำนวน 240 คนซึ่งมีอายุตั้งแต่ 70 ปีขึ้นไป โดยผลการทดลองนั้นไม่พบผลข้างเคียงที่ร้ายแรงแต่อย่างใด ซึ่งเป็นข้อบ่งชี้ที่ชัดเจนว่า ผู้สูงอายุที่ได้รับการฉีดวัคซีนนั้นจะผลิตสารภูมิคุ้มกันได้เท่าเทียมกับผู้ที่มีอายุน้อยกว่า
พอมาถึงวันที่ 23 พ.ย. บริษัทแอสตร้าเซนเนก้าและมหาวิทยาลัยออกซ์ฟอร์ดก็ได้มีการประกาศว่าวัคซีนนั้นมีประสิทธิภาพดี โดยอ้างอิงข้อมูลการศึกษาจาก 131 เคสของโควิด-19 ในกระบวนการทดลองที่ประเทศอังกฤษและที่ประเทศบราซิล ซึ่งอาสาสมัครทั้งหมดนั้นจะได้รับวัคซีนจำนวน 2 โด๊สด้วยกัน แต่ก็มีบางกรณีที่การฉีดวัคซีนโด๊สแรกนั้นจะมีความแข็งแรงของวัคซีนแค่ครึ่งหนึ่งเท่านั้น โดยสิ่งที่น่าแปลกใจก็คือว่าการฉีดวัคซีนที่มีความแข็งแรงเพียงครึ่งเดียวต่อโด๊สนั้นกลับให้ประสิทธิภาพของวัคซีนอยู่ที่ 90 เปอร์เซ็นต์ และถ้าหากเป็นการฉีดวัคซีนโดยปกติด้วยการฉีด 2 โด๊ส จะพบว่าวัคซีนมีประสิทธิภาพอยู่ที่ 62 เปอร์เซ็นต์เท่านั้น
ดังนั้นนักวิจัยจึงได้มีการคาดเดาว่าถ้าหากวัคซีนในโด๊สแรกซึ่งมีการลดปริมาณความแข็งแรงของวัคซีนลงจะสามารถทำหน้าที่ได้ดีกว่าในการจำลองและหลอกร่างกายว่าได้เกิดการติดเชื้อขึ้นแล้วอันจะนำมาซึ่งการผลิตระบบภูมิคุ้มกันที่แข็งแรงกว่า
อย่างไรก็ตาม หลังจากที่มีการประกาศผลการทดลองเรื่องการใช้โด๊สวัคซีนที่มีความแข็งแรงน้อยกว่าออกไป ก็ปรากฎว่าเรื่องดังกล่าวนั้นกลายเป็นผลลัพธ์ซึ่งมาจากความผิดพลาดในกระบวนวิธีการตวงวัคซีน ไม่ใช่แผนการดั้งเดิมในการทดลองวัคซีน และยิ่งไปกว่านั้น ยังปรากฎข้อมูลเพิ่มเติมด้วยว่าการทดลองวัคซีนโดยใช้โด๊สวัคซีนซึ่งมีความแข็งแรงน้อยกว่านั้น แท้จริงแล้วเคยมีการทดลองแค่ครั้งเดียวเท่านั้นก็คือในอาสาสมัครรายหนึ่งที่มีอายุต่ำกว่า 55 ปี ซึ่งนี่ทำให้เกิดข้อสงสัยเกี่ยวกับผลลัพธ์เบื้องต้นของการทดลองทางคลินิกเป็นอย่างยิ่ง
แต่ในวันที่ 26 ธ.ค. ผู้บริหารบริษัทแอสตร้าเซนเนก้าก็ได้ให้สัมภาษณ์กับสำนักข่าวซันเดย์ไทม์ระบุว่ามีข้อมูลชุดใหม่ซึ่งยืนยันได้ว่าวัคซีนนั้นมีประสิทธิภาพเทียบเท่าวัคซีนจากบริษัทโมเดอร์นาหรือจากบริษัทไฟเซอร์และบริษัทไบโอเอ็นเทค โดยสามารถทำให้เกิดภูมิคุ้มกันโรคกับร่างกายได้ถึงร้อยเปอร์เซ็นต์ และอีกไม่นานนี้ก็จะมีการประกาศข้อมูลการทดลองที่ว่านี้อย่างเป็นทางการต่อไป
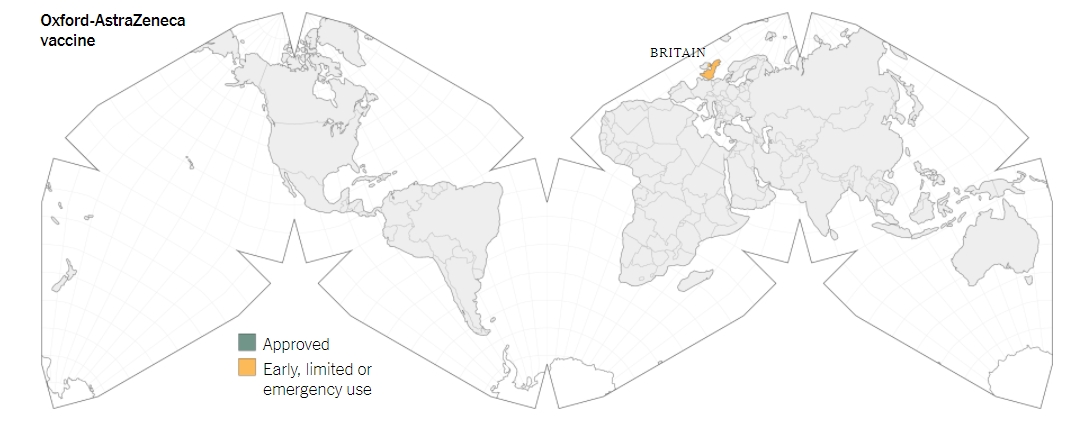
อย่างไรก็ตาม ในวันที่ 30 ธ.ค. ประเทศอังกฤษได้ประกาศใช้งานฉุกเฉินสำหรับวัคซีนของบริษัทแอสตร้าเซนเนก้า โดยในวันที่ 4 ธ.ค. รัฐบาลอังกฤษก็จะเริ่มแผนการฉีดวัคซีนให้กับประชาชนจำนวนหลายล้านโด๊สต่อไป
อนึ่ง เมื่อวันที่ 11 ธ.ค.ที่ผ่านมานั้น มีสิ่งที่ไม่เคยเกิดขึ้นมาก่อนในกระบวนการทดลองวัคซีนสำหรับไวรัสโคโรน่า เมื่อบริษัทแอสตร้าเซนเนก้าได้ประกาศว่าจะร่วมมือกับสถาบันกามาเลยาซึ่งทำวัคซีนจากอะดีโนไวรัสเหมือนกัน โดยผู้ผลิตวัคซีนทั้ง 2 รายนั้นได้รวมกระบวนการทดลองวัคซีนเข้าไว้ด้วยกัน เพื่อจะหาข้อสรุปว่าการวมวัคซีนนั้นจะทำให้ได้ภูมิคุ้มกันที่ยาวนานกว่าการใช้วัคซีนแค่ชนิดเดียวในกระบวนการฉีดวัคซีนทั้ง 2 โด๊สหรือไม่ โดยบริษัทแอสตร้าเซนเนก้าได้เริ่มกระบวนการทดลองวัคซีนแบบผสมที่ว่านี้ครั้งแรกเมื่อวันที่ 24 ธ.ค.ที่ผ่านมา
สำหรับข้อตกลงเกี่ยวกับวัคซีนนั้นมีรายงานว่าในช่วงเดือน พ.ค.ที่ผ่านมา บริษัทแอสตร้าเซนเนก้าได้เริ่มกระบวนการทำข้อตกลงที่จะจัดหาวัคซีนห้กับหลายรัฐบาล ถ้าหากมีการพิสูจน์ออกมาแล้วว่าวัคซีนนั้นสามารถใช้งานได้จริง โดยสหรัฐอเมริกาได้มีการจ่ายเงินสนับสนุนล่วงหน้าไปถึง 1.2 พันล้านดอลลาร์สหรัฐฯ (35,985,600,000 บาท) เพื่อแลกกับวัคซีนจำนวน 300 ล้านโด๊ส และต่อมาในช่วงเดือน ส.ค. อียูก็ได้บรรลุข้อตกลงกับบริษัทแอสตร้าเซนเนก้าในการที่บริษัทจะจัดส่งวัคซีนกล่า 400 ล้านโด๊ส ถ้าหากผลการทดลองออกมาเป็นบวก ส่วนโครงการจัดหาวัคซีนนานาชาติเพื่อให้เกิดความเท่าเทียมกันทั่วโลกหรือโคแวกซ์ (COVAX) ก็ได้มีการทำสัญญากับบริษัทเพื่อจัดหาวัคซีนจำนวน 170 ล้านโดส ซึ่งบริษัทแอสตร้าเซนเนก้าก็ได้ออกมาเปิดเผยว่าถ้าหากวัคซีนมีการอนุมัติอย่างเป็นทางการแล้ว ก็คาดว่าจะสามารถผลิตวัคซีนได้ประมาณปีละ 2 พันล้านโดส
และล่าสุดเมื่อวันที่ 7 ธ.ค.ที่ผ่านมา สถาบันเซรุ่มของอินเดียก็ได้อนุมัติฉุกเฉินให้มีการใช้งานวัคซีน ChAdOx1 ของบริษัทแอสตร้าเซนเนก้า โดยใช้ชื่อวัคซีนในอินเดียว่า Covishield
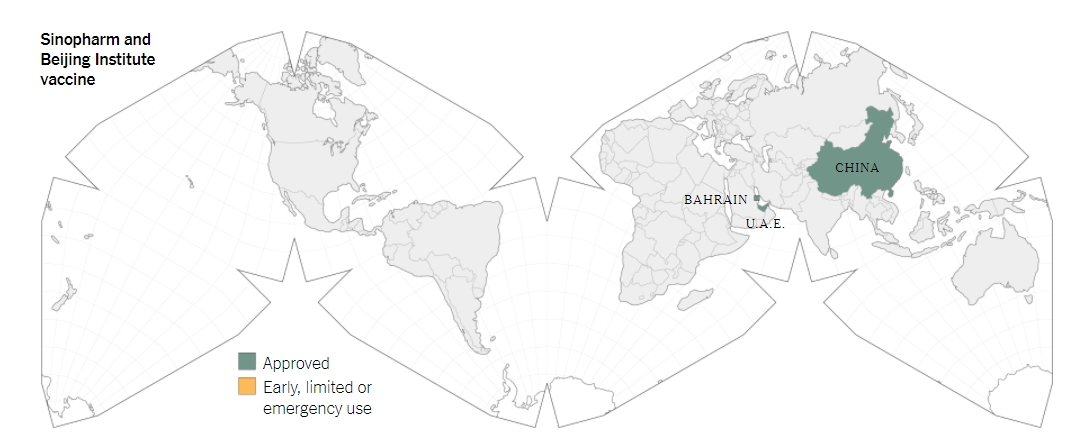
@วัคซีนจากรัฐวิสาหกิจซีโน่ฟาร์มของประเทศจีน
![]()
ชื่อวัคซีน:BBIBP-CorV
ประสิทธิภาพ: 79.34%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 3 สัปดาห์
ที่ผ่านมาสถาบันผลิตภัณฑ์จุลชีวะกรุงปักกิ่งได้สร้างวัคซีนจากซากเชื้อโคโรน่าไวรัส และมีการนำเข้าสู่กระบวนการทดลองทางคลินิก โดยมีผู้นำเนินการคือรัฐวิสาหกิจซีโน่ฟาร์มของประเทศจีน ในวันที่ 30 ธ.ค. ซีโน่ฟาร์มได้ประกาศว่าวัคซีนนั้นมีประสิทธิภาพอยู่ที่ 79.34 เปอร์เซ็นต์ จนทำให้ทางรัฐบาลจีนได้มีการอนุมัติใช้งานวัคซีนดังกล่าว แต่อย่างไรก็ตาม จนถึง ณ เวลานี้ ซีโน่ฟาร์มไม่ได้เปิดเผยข้อมูลเกี่ยวกับการทดลองวัคซีนในระยะที่ 3 แต่อย่างใด
ในช่วงเดือน มิ.ย.ที่ผ่านมา สถาบันฯกรุงปักกิ่งได้รายงานว่าวัคซีนนั้นให้ผลที่น่าประทับใจหลังจากที่มีการทดลองในลิง และต่อการการทดลองทางคลินิกในระยะที่ 1/2 ก็แสดงให้เห็นว่าวัคซีนไม่ได้ก่อให้เกิดผลข้างเคียงที่รุนแรงแต่อย่างใด และสามารถกระตุ้นร่างกายผู้ที่ถูกฉีดให้ผลิตสารภูมิคุ้มกันเพื่อต่อต้านไวรัสโคโรน่า และในช่วงเดือน ก.ค. ก็มีการทดลองในระยะที่ 3 เริ่มต้นที่ประเทศสหรัฐอาหรับเอมิเรตส์และประเทศโมร๊อคโค และในเดือนถัดมาก็มีการทดลองที่ประเทศเปรู
ในวันที่ 14 ก.ย.ประเทศสหรัฐอาหรับเอมิเรตส์ได้อนุมัติฉุกเฉินให้ใช้งานวัคซีนของซีโน่ฟาร์มกับบุคลากรทางการแพทย์และบุคลากรของรัฐบาลกับบุคลากรอื่นๆในเวลาต่อมา และไม่ถึง 2 เดือนหลังจากนั้น ในวันที่ 9 ธ.ค. ประเทศสหรัฐอาหรับเอมิเรตส์ได้มีการอนุมัติเต็มรูปแบบกับวัคซีน BBIBP-CorV ของซีโน่ฟาร์ม โดยมีการประกาศว่าวัคซีนนี้มีประสิทธิภาพอยู่ที่ 86 เปอร์เซ็นต์ รัฐบาลสหรัฐอาหรับเอมิเรตส์ยังได้มีการตั้งคลินิกขึ้นทั่วประเทศ เพื่อให้ประชาชนสามารถไปรับวัคซีนได้ แต่รัฐบาลก็ไม่ได้ประกาศรายละเอียดเกี่ยวกับการประกาศดังกล่าวเลย นี่จึงทำให้เกิดข้อกังขาว่าเกี่ยวกับข้อสรุปของวัคซีนดังกล่าว
และต่อมาในวันที่ 13 ธ.ค. ประเทศเพื่อนบ้านอย่างบาห์เรนก็ประกาศให้มีการใช้งานวัคซีนเต็มรูปแบบเช่นเดียวกันด้วยการวัคซีนแบบเดียวกัน ขณะที่ทางซีโน่ฟาร์มก็ไม่ได้กล่าวถึงรายละเอียดเกี่ยวกับความคืบหน้าการพัฒนาวัคซีนเพิ่มเติม นอกจากนี้ยังมีรายงานด้วยว่าเมื่อวันที่ 31 ธ.ค. ประเทศลาวได้ประกาศว่าได้รับวัคซีนจากซีโน่ฟาร์มจำนวน 2,000 โดสแล้วเช่นกัน
ส่วนที่ประเทศจีนรัฐบาลจีนได้มีการอนุมัติฉุกเฉินวัคซีนของรัฐวิสาหกิจซีโน่ฟาร์มในเดือน ก.ค. เพื่อให้มีการใช้วัคซีนกับบุคลากรทางการแพทย์และกลุ่มบุคคลที่ถูกคัดเลือกและต่อมาในเดือน พ.ย. ประธานรัฐวิสาหกิจซีโน่ฟาร์มได้กล่าวว่าประชาชนเกือบ 1 ล้านคนในประเทศจีนนั้นได้รับวัคซีนไปแล้ว ขณะที่การอนุมัติวัคซีนของซีโน่ฟาร์มเต็มรูปแบบในประเทศจีนนั้นเกิดขึ้นในวันที่ 30 ธ.ค. โดยประเทศจีนวางแผนที่จะฉีดวัคซีนให้กับประชาชนเป็นจำนวนทั้งสิ้น 50 ล้านคนภายในกลางเดือน ก.พ.
@วัคซีนจากบริษัทซีโน่แวกของประเทศจีน
![]()
ชื่อวัคซีน:CoronaVac (ชื่อเดิม PiCoVacc)
ประสิทธิภาพ: มากกว่า 50%
จำนวนที่ใช้: 2 โด๊ส โดยเว้นระยะห่างระหว่างโด๊ส 2 สัปดาห์
ลักษณะการใช้งาน:เก็บรักษาที่อุณหภูมิตู้เย็นทั่วไป
บริษัทซีโน่แวกได้ดำเนินการพัฒนาวัคซีนจากซากเชื้อและเรียกวัคซีนนี้ว่า CoronaVac โดยในวันที่ 23 ธ.ค. นักวิจัยจากประเทศบราซิลได้ประกาศว่าจะมีการทดลองทางคลินิกกับวัคซีนนี้ในระยะที่ 3 และพบว่าวัคซีนนี้มีประสิทธิภาพมากกว่า 50 เปอร์เซ็นต์ และหนึ่งวันหลังจากนั้นประเทศตุรกีก็มีการแถลงข่าวว่าวัคซีนนี้มีประสิทธิภาพอยู่ที่ 91 เปอร์เซ็นต์ แต่ทั้ง 2 ประเทศก็ไม่ได้ให้รายละเอียดอะไรมากนักเกี่ยวกับการทดลอง และคาดกันว่าบริษัทซีโน่แวกน่าจะเปิดเผยผลการทดลองในระยะ 3 ได้ในช่วงต้นเดือน ม.ค.
โดยเมื่อตอนเดือน มิ.ย.ที่ผ่านมา บริษัทซีโน่แวกได้ประกาศถึงผลการทดลองในระยะที่ 1/2 กับกลุ่มอาสาสมัครจำนวน 743 ราย พบว่าไม่พบผลข้างเคียงที่รุนแรงแต่อย่างใด และวัคซีนยังสามารถที่จะทำให้เกิดภูมิคุ้มกันในตัวอาสาสมัครได้ ต่อมาเมื่อเดือน พ.ย.บริษัทซีโน่แวกก็ได้มีการตีพิมพ์ผลการทดลองในวารสารทางการแพทย์ระบุว่าวัคซีนนั้นสามารถทำให้เกิดการผลิตสารภูมิคุ้มกันได้ประมาณหนึ่ง และสำหรับการทดลองทางคลินิกในระยะที่ 3 นั้น เมื่อช่วงเดือน ก.ค.ที่ผ่านมา บริษัทซีโน่แวกได้ดำเนินการทดลองทางคลินิกในระยะที่ 3 ที่ประเทศบราซิล และต่อมาก็ที่ประเทศอินโดนีเซียและที่ประเทศตุรกีตามลำดับ
และในช่วงเดือน ก.ค.ที่ประเทศจีน รัฐบาลจีนก็ได้มีการอนุมัติฉุกเฉินให้ใช้งานวัคซีน CoronaVac โดยเป็นการใช้งานวัคซีนแบบจำกัดวง ก่อนที่ในเดือน ต.ค. หน่วยงานท้องถิ่นในเมืองเจียเซียงจะประกาศเช่นกันว่าได้มีการอนุมัติให้ใช้งานวัคซีนแบบจำกัดวงกับผู้ประกอบอาชีพซึ่งมีความเสี่ยงในการติดเชื้อสูง อาทิ บุคลากรทางการแพทย์ ผู้ตรวจการท่าเรือ และเจ้าหน้าที่ซึ่งต้องให้บริการประชาชน
ในขณะเดียวกัน บริษัทซีโน่แวกเองก็ได้ประกาศว่าได้เตรียมการสำหรับการแจกวัคซีนไปทั่วโลกแล้ว โดยในช่วงเดือน ก.ค.ที่ผ่านมา ได้มีการบรรลุข้อตกลงกับประเทศอินโดนีเซียในการจัดส่งวัคซีนจำนวนกว่า 40 ล้านโด๊ส,บรรลุข้อตกลงกับประเทศยูเครนในการส่งวัคซีนจำนวน 1.8 ล้านโด๊ส ต่อมาช่วงเดือน ก.ย.นาย Yin Weidong ผู้บริหารของบริษัทซีโน่แวกได้กล่าวว่าบริษัทได้วางแผนการแจกจ่ายวัคซีนไปทั่วโลกในต้นปี 2564 รวมไปถึงประเทศสหรัฐอเมริกาด้วยเช่นกัน
ซึ่งก่อนหน้าจะสิ้นปี 2564 บริษัทซีโน่แวกได้เคยประกาศว่าตั้งเป้าเอาไว้ว่าจะผลิควัคซีนให้ได้ภายในปี 2563 เป็นจำนวน 300 ล้านโด๊ส และจะเพิ่มการผลิตต่อไปเป็นปีละ 600 ล้านโด๊ส
เรียบเรียงเนื้อหาและรูปภาพจาก:https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html
#กดคลิก ติดตาม ส่งแชร์ข่าวอิศรา ได้ที่นี่ https://www.facebook.com/isranewsfanpage



 Isranews Agency | สำนักข่าวอิศรา
Isranews Agency | สำนักข่าวอิศรา